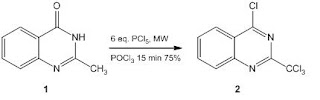
Chemicy francuscy pokazali ciekawą sekwencję prowadzącą do pochodnych chinazolin [1] z wykorzystaniem 2-metylochinazol-(3H)4-onu [2] 1 jako substratu.
Związek 1 reaguje z chlorkiem fosforu(V) w obecności tlenku chlorku fosforu(V) w wyniku czego następuje wprowadzenie czterech atomów chloru do cząsteczki i utworzenie 4-chloro-2-trichlorometylochinazoliny 2: [2]
Chlorochinazolina 2 stosunkowo łatwo reaguje z aminami zarówno alifatycznymi, jak i aromatycznymi z wytworzeniem 4-alkilo(arylo)aminopochodnych: [1]
Trzy związki 3 z podstawnikiem 3-ClC6H5, 3-CF3C6H5 oraz 2,4-diClC6H3 zostały poddane redukcji żelazem w środowisku kwasu octowego, w wyniku czego zostały usunięte atomy chloru i powstały związki 4 z grupami metylowymi.
Dodatkowe informacje na temat uzyskanych produktów redukcji.
Produkt 4 z podstawnikiem 3-chlorofenylowym: ciało stałe o kolorze beżowym, t.t 171°C 1H NMR (200 MHz, CDCl3) d: 2.72(s, 3H), 7.11(dd, 1H, J = 0.9 i 8.0 Hz), 7.32(dd, 1H, J = 8.0 i 8.2 Hz), 7.5(dd, 1H, J = 0.9 i 8.0 Hz), 7.64-7.88(m, 5H), 8.01(br, s, 1H).
Produkt 4 z podstawnikiem 3-trifluorometylofenylowym: ciało stałe o kolorze beżowym, t.t 178°C 1H NMR (200 MHz, CDCl3) d: 2.72(s, 3H), 7.4(d, 1H, J = 7.7 Hz), 7.52(dd, 2H,J = 7.3 i 7.7 Hz), 7.74-8.06(m, 5H), 8.23(br, s, 1H).
Produkt 4 z podstawnikiem 2,4-dichlorofenylowym: ciało stałe, t.t. 154°C 1H NMR (200 MHz, CDCl3) d: 2.75(s, 3H), 7.32-7.38(m, 1H), 7.45-7.46(m, 1H), 7.77-7.85(m, 1H), 7.90-7.94(m, 2H), 8.19(br, s, 1H), 8.88(d, 1H, J=8.3 Hz).